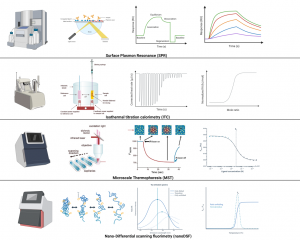
一、表面等离子共振技术(SPR)
表面等离子共振技术(SPR)是一种高敏感度的生物分析方法,广泛应用于分子交互作用的实时监测和定量分析。SPR技术通过测量表面等离子波与光波之间的相互作用,揭示分子之间的结合、解离过程,从而为生物学研究、药物研发、临床诊断等领域提供了强大的支持。
技术原理
SPR技术基于表面等离子共振效应,其核心原理是在金属薄膜表面激发等离子共振波。当光通过金属薄膜时,只有当光的入射角与表面等离子共振角匹配时,光的反射强度会发生显著变化。这一变化与表面上分子相互作用的发生密切相关。因此,通过监测反射光强度的变化,SPR能够实时、无标记地探测分子间的结合和解离过程。
适用范围
- 生物分子间相互作用分析:如抗原-抗体、酶-底物、受体-配体等分子间的结合动力学研究。
- 药物筛选与评估:可以用于药物候选分子的结合力分析,帮助筛选潜力药物。
技术特点
1.实时监测;2.高灵敏度;3.无标记检测;4.高通量筛选
- 微量热泳动技术(MST)
微量热泳动技术(MST,Microscale Thermophoresis)是一种用于高灵敏度检测分子间相互作用的现代生物分析技术。MST基于热泳动原理,通过监测分子在温度梯度下的运动,实时、定量地分析分子间的结合动力学、亲和力及结合位点。与传统技术相比,MST具有较高的灵敏度和准确性,且适用于多种分子类型,是药物筛选、蛋白质相互作用研究等领域的强大工具。
技术原理
MST技术的核心原理是利用温度梯度引起的热泳动现象。当一个溶液中的分子在温度梯度作用下,会出现向低温区域迁移的现象,这种现象被称为热泳动。通过在样本中施加微小的温度梯度,MST可以测量分子在此梯度下的运动行为。结合不同浓度的分析物,可以得到分子结合反应的热泳动变化,从而推算出分子间的结合亲和力和动力学参数。
MST技术使用荧光标记分子,监测分子在温度变化下的荧光强度变化,通过分析分子的热泳动行为来提供分子间相互作用的信息。
适用范围
- 分子相互作用研究:能够高灵敏度地分析蛋白质-蛋白质、蛋白质-小分子、核酸-蛋白质等不同类型的分子间相互作用。
- 药物筛选与优化:通过检测小分子与靶蛋白的结合亲和力和动力学,帮助筛选和优化药物候选分子。
- 抗体工程:用于评估抗体与抗原的结合亲和力,推动抗体药物开发。
- 酶-底物动力学:可以研究酶和底物之间的相互作用及动力学特性。
- 生物分子功能研究:用于分析RNA、DNA及其他生物大分子之间的相互作用。
技术特点
1.高灵敏度2.无需标记物3.低样本需求4.实时定量分析5.温和实验条件
- 等温滴定量热法(ITC)
等温滴定量热法(ITC,Isothermal Titration Calorimetry)是一种高度灵敏的热量测量仪器,用于精确研究分子间的相互作用及其热力学特性。ITC通过直接测量反应中伴随的热量变化,实时获得分子结合反应的热力学参数,包括结合热、结合亲和力、反应动力学等信息。ITC广泛应用于生命科学、药物研发、化学反应动力学等领域,是研究分子识别和相互作用的重要工具。
技术原理
ITC的核心原理是基于热量测量,通过监测分子间相互作用所释放或吸收的热量变化。当一个试剂(例如配体)以一定浓度逐渐加入到一个含有目标分子(例如受体)的溶液中时,若两者发生相互作用,会伴随有热量的释放或吸收。ITC仪器能够精确记录每次滴定过程中产生的微小热变化,并且利用等温条件下的热流量数据,计算出分子结合反应的热力学参数,如结合常数(Ka)、反应热(ΔH)、反应自由能(ΔG)和反应熵(ΔS)等。
适用范围
- 分子间相互作用研究:ITC可以用来研究蛋白质-蛋白质、蛋白质-小分子、DNA-蛋白质等分子间的结合动力学和热力学特性。
- 药物筛选与优化:用于研究药物候选分子与靶标的结合亲和力、结合热力学等,为药物筛选和优化提供数据支持。
- 抗体和抗原结合:ITC可以精确测定抗体与抗原之间的结合热力学特性,帮助抗体药物的开发和优化。
- 酶-底物反应研究:用于研究酶与底物、抑制剂等分子之间的相互作用和反应机制。
- 聚合物、表面活性剂等的相互作用:ITC可用于研究聚合物、表面活性剂等大分子与小分子、离子之间的相互作用。
- 热力学性质研究:广泛用于研究分子反应过程中的热力学参数,包括结合常数、热容变化、自由能等。
技术特点
1.直接测量热量变化2.高灵敏度和高准确性3.实时分析4.全面的热力学数据5.无需标记物6.操作简便
- 微量差示扫描荧光技术(nanoDSF)
微量差示扫描荧光技术(nanoDSF,nano Differential Scanning Fluorimetry)是一种高灵敏度、非侵入性的分析技术,用于研究蛋白质、核酸等生物大分子的结构稳定性和热变性过程。通过监测分子在加热过程中荧光信号的变化,nanoDSF能够提供关于分子折叠、热稳定性及分子相互作用的定量数据。该技术广泛应用于蛋白质工程、药物开发、分子动力学研究等领域,是研究生物大分子稳定性和结构变化的理想工具。
技术原理
nanoDSF技术基于荧光信号的温度依赖性变化原理。当蛋白质等大分子在加热过程中经历构象变化时,其内部疏水区域会暴露出来,导致荧光信号发生变化。nanoDSF主要通过两种荧光信号来检测这些变化:一是来自荧光探针,如Trp(色氨酸)的自发荧光,二是使用溶液中加入的荧光染料,如荧光素类物质,这些探针能够结合到疏水区并发射特征荧光。随着温度的升高,蛋白质等大分子的折叠状态发生变化,从而引起荧光强度的改变。通过分析荧光信号的变化,nanoDSF可以精确测定蛋白质的熔解温度(Tm)、热稳定性以及可能的构象变化。
适用范围
- 蛋白质稳定性研究:nanoDSF可以用来研究蛋白质在不同环境下的热稳定性,为蛋白质工程、优化和改造提供有价值的数据。
- 药物筛选和优化:nanoDSF可用于评估小分子药物与蛋白质之间的相互作用,并检测药物对蛋白质稳定性的影响,有助于筛选和优化药物候选分子。
- 抗体与抗原的结合研究:该技术适用于抗体药物开发过程中,评估抗体的稳定性和与抗原结合的亲和力。
- 酶和其他生物大分子的折叠与解折叠:nanoDSF能够帮助研究酶、核酸以及其他生物大分子的构象变化,揭示其折叠与解折叠的机制。
- 蛋白质-配体相互作用:通过分析蛋白质与小分子、配体结合后的热稳定性变化,nanoDSF能够提供精确的结合亲和力和动力学信息。
技术特点
1.高灵敏度2.无需标记3.快速、实时分析4.小样本量需求5.温和的实验条件6.多功能分析7.定量热力学数据
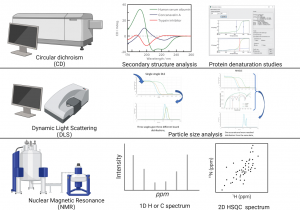
- 圆二色谱(CD)
圆二色谱(CD,Circular Dichroism)是一种重要的光谱分析技术,广泛应用于分子结构研究,特别是在蛋白质、核酸等大分子的二级结构、构象变化及相互作用分析中。圆二色谱利用分子对左右圆偏振光的不同吸收特性,为研究生物分子折叠状态、动态变化及药物-靶标相互作用提供了有力支持。由于其非侵入性、无标记性和高灵敏度,CD技术已成为生命科学、药物研发及生物分子结构研究中的核心工具之一。
技术原理
圆二色谱技术基于分子对不同偏振光的吸收特性。在光学活动分子中,左右圆偏振光的吸收程度是不同的,分子通过吸收一部分光能量后会产生不同的圆二色效应。CD谱图通过测量分子对左右圆偏振光的吸收差异,提供分子结构、构象及动力学的关键信息。具体而言,当光通过样品时,分子中的化学键、氨基酸残基或核酸基团等结构单元会与光相互作用,导致光的旋转或吸收。通过解析CD信号,可以获得分子在不同环境下的二级结构信息,如α螺旋、β折叠、无规则卷曲等。
适用范围
- 蛋白质二级结构分析:CD是研究蛋白质折叠、二级结构组成(如α螺旋、β折叠等)的常用方法,帮助科学家了解蛋白质的结构与功能关系。
- 核酸结构研究:通过CD技术,可以研究DNA、RNA等核酸的二级结构及其在不同环境下的构象变化。
- 药物与蛋白质的相互作用:CD用于研究药物候选分子与靶标蛋白的相互作用,揭示其对蛋白质折叠及构象稳定性的影响。
- 蛋白质折叠与变性研究:通过监测蛋白质在不同条件下的二级结构变化,CD能够提供蛋白质折叠过程、热变性等相关信息。
- 生物大分子相互作用:CD技术可以监测多种生物分子之间的相互作用,包括蛋白质-蛋白质、蛋白质-小分子、蛋白质-核酸等,帮助揭示分子间的相互作用机制。
- 动态光散射(DLS)
动态光散射(DLS,Dynamic Light Scattering)是一种广泛应用于纳米粒子、胶体溶液及生物大分子研究的高效技术。DLS通过分析粒子在液体中的布朗运动来测定其粒径分布,具有高灵敏度和快速分析的优势。它能够准确地获取样品中粒子的大小、分布和稳定性等信息,是纳米技术、药物开发以及生物物理学等领域的重要分析工具。
技术原理
动态光散射技术基于布朗运动原理。当光束照射到溶液中的粒子时,粒子会因热运动而发生散射。由于粒子不断运动,散射光的强度和角度也会发生变化。DLS通过测量这些散射光的时间变化,利用相关函数(correlation function)分析粒子运动的速度,进而计算粒子的扩散系数。根据斯托克斯-爱因斯坦方程,可以从扩散系数推算出粒子的粒径大小。
粒子的运动速度与其大小成反比,较小的粒子运动较快,而较大的粒子运动较慢。通过分析散射光的时间相关性,DLS能够提供关于粒子尺寸分布的详细信息,适用于纳米尺度到微米尺度的粒子检测。
适用范围
- 纳米粒子表征:DLS是纳米技术中常用的粒度分析方法,能够精确测定纳米粒子、纳米药物载体和胶体溶液的粒径分布,帮助优化纳米材料的设计。
- 蛋白质与生物大分子研究:在生物学研究中,DLS可用于分析蛋白质、病毒、胶体和其他生物大分子的粒径和聚集行为,研究其在不同条件下的稳定性和折叠状态。
- 药物开发与制剂:DLS能够帮助开发者监测药物纳米颗粒、乳液、胶体药物载体等的粒径分布和稳定性,为药物制剂提供重要数据支持。
- 溶液与胶体研究:DLS广泛用于研究溶液中的胶体粒子、表面活性剂溶液等体系,帮助分析这些体系的稳定性、聚集性及粒度分布。
- 高分子与聚合物分析:DLS也可用于研究高分子、聚合物以及其在溶液中的自组装行为,尤其是在药物传递和材料科学领域的应用。
 合肥中科长木生物科技有限公司
合肥中科长木生物科技有限公司
您好!请登录